Jakie są krytyczne okresy w rozwoju zarodka? Czas zachować ostrożność (krytyczne okresy ciąży)
Są pewne okresy rozwoju wewnątrzmacicznego, kiedy zarodek jest szczególnie wrażliwy na czynniki szkodliwe - okresy krytyczne lub wrażliwe. Charakteryzują się dużą szybkością reprodukcji komórek i syntezy białek, w tym narządowo-specyficznych (okres największego napięcia to zryw); W tych okresach zarodek wchodzi w nowy etap morfogenezy; są one najbardziej niebezpieczne dla życia zarodka. U ludzi pierwszy okres występuje w pierwszym tygodniu ciąży – w okresie przedimplantacyjnym lub okresie embriogenezy jajowodów; drugi okres - od 3 do 8 tygodni - to okres większej organogenezy, w tym powstawania łożyska. Większość embriopatii powstaje w wyniku działania szkodliwych czynników w tych krytycznych okresach rozwoju. Jednak mózg, układ hormonalny i układ rozrodczy płód może zostać uszkodzony na każdym etapie rozwoju, ponieważ ich okresy krytyczne przekraczają 8 tygodni. Za krytyczny okres uważa się także 3 miesiąc ciąży, w którym kończy się tworzenie łożyska, a jego funkcja charakteryzuje się dużą aktywnością. W tym okresie u płodu pojawiają się nowe odruchy, powstają podstawy kory mózgowej; Powstaje hematopoeza szpiku kostnego, we krwi pojawiają się leukocyty; aktywowane są procesy metaboliczne. Proponuje się podkreślić inny krytyczny okres - 20-24 tygodnie życie wewnątrzmaciczne płód W tym czasie następuje kształtowanie się jego najważniejszych układów funkcjonalnych.
Charakter zmian patologicznych zarodka w dużej mierze zależy od czasu narażenia na działanie czynników uszkadzających. Narażenie na czynnik chorobotwórczy w pierwszym krytycznym okresie może prowadzić do śmierci lub wystąpienia ogólnych anomalii (opóźnienie rozwoju, zmniejszona żywotność płodu); uszkodzenie wyrządzone w drugim okresie krytycznym powoduje zmiany morfologiczne w tym czy innym narządzie, w połączeniu z ogólnymi anomaliami rozwojowymi. Co więcej, im wcześniej zadziała czynnik uszkadzający, tym bardziej rozległe zmiany zachodzą w zarodku. Najbardziej niebezpieczne pod względem uszkodzeń są: za układ nerwowy- 18 dzień ciąży; dla serca - 25-38 dni; dla kończyn - 25-35 dni; dla genitaliów - 36-180 dni. Ustalono, że różne czynniki chorobotwórcze działające jednocześnie powodują te same zmiany; podobne wpływy wpływające różne terminy dać różne wyniki. Na przykład napromieniowanie ciężarnych samic szczurów taką samą dawką promieni rentgenowskich w 10. dniu ciąży powoduje bezmózgowie, w 11. dniu - mikro- i brak oczu, w 12. dniu - obrzęk olbrzymi ciała, w 14. dniu - anomalie kończyn.
Nie bez znaczenia jest także miejsce narażenia na czynnik uszkadzający. Zatem eksperymentalne wprowadzenie czynnika chorobotwórczego do woreczka żółtkowego nie zmienia organogenezy i jej czasu; natomiast nałożenie tej samej substancji na powierzchnię kosmówki lub wprowadzenie do jej jamy zakłóca organogenezę.
Dla płodu, który pomyślnie przetrwał krytyczne okresy wczesnej embriogenezy, najbardziej niebezpieczne są ostatnie tygodnie życia wewnątrzmacicznego, kiedy następuje rozdźwięk pomiędzy stosunkowo szybkim przyrostem masy płodu a ustaniem wzrostu łożyska, a także okresem wstępna adaptacja organizmu do nowego środowiska zewnętrznego, z jakim spotyka się po urodzeniu (okres okołoporodowy – od 28 tygodnia życia wewnątrzmacicznego do 8 dnia okresu noworodkowego).
Czynniki uszkadzające działają bezpośrednio na płód, uszkadzając komórkę i jej normalne funkcjonowanie lub zaburzając krążenie maciczno-łożyskowe i funkcję łożyska.
Wraz z dużym uszkodzeniem kręgosłupa ciała wewnątrzmacicznego do niego Istnieje również pewna zdolność do kompensacji. Im wcześniej wystąpiła szkoda, która w szczególności doprowadziła do opóźnień rozwojowych, tym pełniejsze może być zadośćuczynienie. Tak więc, jeśli u zwierząt (króliki, szczury) w pierwszej połowie ciąży część naczyń przedłożyskowych macicy zostanie podwiązana, to w ciągu następnych kilku dni odkryje się opóźnienie w rozwoju płodu i ostro zdeformowane łożysko . Ale po tej samej operacji płody urodzone w terminie i ich łożysko nie różnią się od normalnych (N.L. Garmasheva).
Opóźnienie rozwojowe różne narządy zachodzi nierównomiernie, a ich zdolność do kompensacji jest również inna. Tak więc, gdy neurony są słabo rozwinięte przed urodzeniem, możliwa jest tylko daleka od pełnej rehabilitacji funkcjonalnej, a konsekwencje objawiają się poważnymi zjawiskami neurologicznymi i upośledzeniem umysłowym.
Rozwój wewnątrzmaciczny, począwszy od zapłodnienia, trwa 266 dni (lub 280 dni od 1. dnia ostatnia miesiączka) i ma dwa okresy - embrionalny i płodowy.
1. Okres embrionalny.
1) Trwa trzy tygodnie. Charakteryzuje się przekształceniem komórki jajowej w mały zarodek, który zostaje wszczepiony w błonę śluzową macicy.
2) Trwa do 10 tygodnia ciąży. Komórki rozrodcze ulegają fragmentacji, migrują i różnicują się w różne specyficzne narządy.
Pod koniec 8 tygodnia główne struktury narządów są zróżnicowane, ale rozwój funkcjonalny narządów nie jest zakończony - w tym okresie mogą wystąpić poważne wady.
2. Okres płodowy.
Od 10 tygodnia ciąży aż do porodu dominują procesy wzrostu. Najbardziej ważne punkty w tym okresie: kształtowanie się podniebienia, różnicowanie zewnętrznych narządów płciowych i histogeneza ośrodkowego układu nerwowego.
W okresie płodowym czynniki szkodliwe nie powodują powstawania wad morfologicznych, ale mogą powodować różnego rodzaju zaburzenia zachowania lub zaburzenia rozwój umysłowy w okresie poporodowym.
Krytyczne okresy rozwoju rozumiane są jako momenty rozwoju, które charakteryzują się spowolnieniem procesu wzrostu struktur, wzrostem entropii i spadkiem nadmiaru informacji w układach biologicznych do wartości minimalnych, prowadzących do powstania nowej jakości. Znajomość krytycznych okresów rozwoju jest podstawą zrozumienia wpływu środowiska na ontogenezę i patogenezę embriopatii, w tym chorób dziedzicznych i wad rozwojowych.
Wyróżnia się następujące krytyczne okresy rozwoju:
1. Dla całego organizmu - czynniki szkodliwe mogą doprowadzić do śmierci zarodka. Zatem według WHO w trakcie normalna ciąża Na 1000 ciąż umiera 300 płodów.
2. Szczególne okresy krytyczne - istnieją w ontogenezie każdego narządu - heterogeniczność związana z niejednoczesnym powstawaniem i tempem różnicowania narządów i układów - występowanie kilku krytycznych okresów rozwoju narządu, odpowiadających zachowanej filembryogenezie i wprowadzony przez nich etap ustalenia.
3. Okresy krytyczne rozwój komórki jako układu biologicznego. Istnieją dowody na istnienie krytycznych okresów w rozwoju poszczególnych organelli komórkowych.
1. okres krytyczny od 0 do 10 dni – brak połączenia z ciało matki embrion albo umiera, albo rozwija się (zasada „wszystko albo nic”). Odżywianie zarodka jest autotropowe, ze względu na substancje zawarte w jaju, a następnie na skutek wydzielania płynnego trofoblastu w jamie blastocysty.
Drugi okres krytyczny od 10 dni do 12 tygodni następuje powstawanie narządów i układów oraz pojawiają się liczne wady rozwojowe. Nie tyle wiek ciążowy ma znaczenie, co czas trwania narażenia na niekorzystny czynnik.
Trzeci okres krytyczny (w obrębie drugiego) 3-4 tygodnie – początek tworzenia się łożyska i kosmówki. Naruszenie jego rozwoju prowadzi do niewydolność łożyska i w konsekwencji do śmierci zarodka lub rozwoju niedożywienia płodu.
Czwarty okres krytyczny 12-16 tygodni tworzą się zewnętrzne narządy płciowe. Wprowadzenie estrogenu może prowadzić do dysplazji nabłonka macicy i pochwy w wieku dorosłym.
Piąty okres krytyczny 18-22 tygodnie, zakończenie tworzenia układu nerwowego.
Czynniki wpływające na rozwój płodu dzielimy na egzogenne i endogenne:
Fizyczne (temperatura, skład gazowy powietrza, promieniowanie jonizujące itp.);
Chemikalia (substancje stosowane w przemyśle, w życiu codziennym, przenikające przez barierę łożyskową, substancje lecznicze, narkotyki, nadmiar witamin A, D, C, alkohol, nikotyna itp.);
Odżywcze (niedożywienie zwiększa wady rozwojowe płodu 3-4 razy);
Chroniczny głód tlenu (przewlekła niedotlenienie prowadzi do niedożywienia);
Patologia pozagenitalna(patologia zakaźna, infekcja wirusowa, na którą cierpi kobieta w ciąży).
Promieniowanie jonizujące: niskie dawki promieniowania prowadzą do zaburzeń metabolicznych, chorób dziedzicznych (zwiększona liczba wad, nowotworów). tarczyca itp.).
MEMBRANY GERMINALNE
błony w zarodkach niektórych bezkręgowców i wszystkich wyższych kręgowców, zapewniające żywotną aktywność zarodka i chroniące go przed uszkodzeniem - owodni, kosmówki, alantois. Powstają z powodu pozazarodkowych części listków zarodkowych. W przeciwieństwie do błon jaj, 3. o. Nie rozwijają się podczas dojrzewania jaja, ale podczas rozwoju embrionalnego i są narządami tymczasowymi. Owodnia utworzona jest albo przez boczne fałdy pozazarodkowej ektodermy i mezodermy (zewnętrzny liść blaszek bocznych), które wznoszą się i zamykają nad zarodkiem, albo przez utworzenie wnęki pomiędzy komórkami rozrodczymi, które stopniowo przekształcają się w błona otaczająca zarodek. Owodnia jest wypełniona płynem i chroni zarodek przed wysychaniem, chroni go przed kontaktem z innymi błonami, czasem bardzo gęstymi (na przykład skorupą jaja) oraz przed uszkodzeniami mechanicznymi. szkoda. Zew. ściana owodniowa fałdy tworzą kosmówka (obecna tylko u owodniowców). U gadów i ptaków to 3. o. zwykle tzw błona surowicza. U ssaków kosmówka ma bezpośredni kontakt ze ścianą macicy, zapewniając wymianę substancji między ciałem matki a płodem; układany jest na wczesnym etapie rozwoju (kiedy zarodek jest nadal reprezentowany przez blastocystę), powstaje z komórek otaczających blastocystę - trofoblastu, pod którym następnie znajduje się mezoderma pozazarodkowa. W kosmówce znajdują się kosmki, które początkowo reprezentują wzrost komórek trofektodermy w tkankach macicy (kosmki pierwotne). Po wrośnięciu w nie naczyń omoczniowych (kosmków wtórnych) tworzą one płodową część łożyska. Allantois (obecny tylko u owodniowców) powstaje jako wyrostek tylnej części rurki jelitowej zarodka. U gadów i ptaków w wyniku połączenia warstw mezodermalnych kosmówki i alantois powstaje kosmówka omoczniowa w kształcie worka, która silnie rośnie i pokrywa zewnętrzną powierzchnię owodni i woreczka żółtkowego. Wyposażony w dużą ilość naczynia krwionośne kosmówka omoczniowa służy jako embrionalny narząd oddechowy i zbiera produkty przemiany materii zarodka (głównie mocz). U ssaków alantois jest mała; naczynia pępowinowe powstają w jej mezenchymie. Aby uzyskać więcej późne etapy rozwoju pęcherz powstaje z śródzarodkowej części omoczni
Takie okresy, które charakteryzują się zwiększona wrażliwość na działanie czynników szkodliwych nazywane są „krytycznymi okresami embriogenezy”. Prawdopodobieństwo wystąpienia odchyleń rozwojowych w okresach krytycznych jest największe.
Tworzą się poszczególne tkanki i narządy różne okresy wzrost zarodka i płodu. Jednocześnie tkanki organizmu w momencie maksymalnego nasilenia procesów różnicowania stają się bardzo wrażliwe na szkodliwe działanie środowisko zewnętrzne(promieniowanie jonizujące, infekcje, czynniki chemiczne).
Takie okresy, które charakteryzują się zwiększoną wrażliwością na działanie czynników szkodliwych, nazywane są „krytycznymi okresami embriogenezy”. Prawdopodobieństwo wystąpienia odchyleń rozwojowych w okresach krytycznych jest największe. Wymieńmy główne okresy krytyczne w rozwoju zarodka i płodu.
Okres blastogenezy
Według WHO pierwszy krytyczny okres rozwoju przypada na pierwsze 2 tygodnie rozwoju – okres blastogenezy. Reakcja w tym okresie realizowana jest zgodnie z zasadą „wszystko albo nic”, to znaczy zarodek albo umiera, albo ze względu na zwiększoną stabilność i zdolność do regeneracji nadal normalnie się rozwija. Zaburzenia morfologiczne występujące w tym okresie nazywane są „blastopatiami”. Należą do nich anembrionia, która powstaje w wyniku przedwczesnej śmierci i resorpcji zarodka, aplazja woreczek żółtkowy itp. Niektórzy badacze zaliczają ciążę pozamaciczną i zaburzenia głębokości zagnieżdżenia rozwijającego się zarodka do blastopatii. Większość zarodków uszkodzonych w czasie blastogenezy, a także tych powstałych z wadliwych komórek rozrodczych niosących mutacje, ulega w tym okresie eliminacji w wyniku samoistnych poronień. Według literatura naukowa Częstość przerywania ciąży na tym etapie wynosi około 40% wszystkich ciąż. Najczęściej kobieta nie ma nawet czasu, aby dowiedzieć się o jego wystąpieniu i traktuje epizod jako opóźnienie cykl menstruacyjny.
Okres embrionalny
Drugi okres krytyczny rozwój wewnątrzmaciczny trwa od 20. do 70. po zapłodnieniu – jest to czas największej wrażliwości zarodka. Cały okres embrionalny – od momentu zagnieżdżenia do 12. tygodnia – jest bardzo ważnym okresem w rozwoju człowieka. Jest to czas, w którym następuje układanie i formowanie wszystkich ważnych narządów, kształtuje się krążenie łożyskowe, a zarodek nabiera „ludzkiego wyglądu”.
Okres płodowy (płodowy).
Okres płodowy trwa od 12 tygodni do porodu. W tym czasie organizm dojrzewa - drobne zróżnicowanie narządów i tkanek, któremu towarzyszy szybki wzrost płodu. Kiedy pod wpływem niekorzystne czynniki Na rozwijającym się organizmie w okresie embrionalnym powstają tzw. „embriopatie”, które objawiają się wadami rozwojowymi. Te same zagrożenia, które wpływają na płód w okresie płodowym, powodują rozwój fetopatii, dla której wady morfologiczne nie są charakterystyczne. Częstotliwość embriopatii jest dość wysoka - spontaniczne poronienia Co najmniej 10% zarejestrowanych ciąż kończy się w okresie embrionalnym.
W pierwszych 2-3 miesiącach życia wewnątrzmacicznego dochodzi do intensywnego podziału komórek oraz tworzenia się tkanek i narządów. Dzięki podziałowi, wzrostowi i migracji komórek każda część ciała nabiera określonego kształtu – zachodzi proces morfogenezy. Zasadniczo procesy morfogenezy kończą się w 8. tygodniu rozwoju. Na podstawie wiedzy o czasie tworzenia się narządu można wyciągnąć wnioski na temat rozwoju wad wrodzonych w związku z wpływem określonych zagrożeń na zarodek. Na przykład w literaturze zgromadzono wiele danych na temat teratogennego działania leków przeciwdrgawkowych, w szczególności walproinianu. Lek ten może wywoływać kompleksy wrodzone anomalie, w tym połączenie rozszczepu kręgosłupa z ubytkiem przegrody międzykomorowej. Takie wady można zaobserwować w przypadku zespołu walproinianu, ale w tym celu konieczne jest, aby kobieta przyjmowała lek do 8 tygodnia ciąży, ponieważ do tego czasu zakończone jest zamknięcie przegrody międzykomorowej i utworzenie kanału kręgowego.
Zaburzenia rozwojowe w okresie płodowym nazywane są fetopatiami (od łacińskiego „płód” - płód). Wady rozwojowe w tym okresie mogą wystąpić tylko w narządach, które nie zakończyły swojego tworzenia (tkanka mózgowa, zęby, narządy płciowe, płuca). Okres ten charakteryzuje się powstawaniem tak zwanych „wtórnych” wad rozwojowych - to znaczy zaburzeń w rozwoju normalnie utworzonych narządów z powodu procesów zapalnych (na przykład toksoplazmoza, infekcje wirusowe) lub zaburzenia dojrzewania prowadzące do powstania dysplazji lub hipoplazji narządów i tkanek.
Umiejętność reagowania procesy zapalne w przypadku uszkodzeń zakaźnych u płodu powstaje po 5 miesiącu rozwoju. Do patologii okresu płodowego przyczyniają się także zaburzenia metaboliczne i przewlekłe zatrucie matki; jako przykład można podać fetopatię cukrzycową i alkoholową. Spośród zaburzeń rozwoju wewnątrzmacicznego największe kliniczne i znaczenie społeczne mają wady wrodzone (CDD).
Współczesna nauka uważa, że co najmniej 50% wszystkich wrodzonych nowotworów złośliwych ma złożony charakter wieloczynnikowy, to znaczy powstają pod wpływem czynników dziedzicznych i środowiskowych, podczas gdy 5% wrodzonych nowotworów złośliwych jest wywoływanych przez wpływy teratogenne. Działanie teratogenne obejmuje każdą szkodliwą substancję, pod wpływem której mogą powstać wrodzone wady rozwojowe.
Znanych jest jednak kilkaset czynników teratogennych znaczenie praktyczne ludzie mają tylko kilka:
- Choroby endokrynologiczne matki (cukrzyca);
- Skutki fizyczne (temperatura lub jonizacja);
- Substancje chemiczne, w tym niektóre leki (retinoidy, kwas walproinowy, talidomid itp.) i alkohol;
- Czynniki biologiczne (infekcje - toksoplazmoza, różyczka itp.)
Niektóre z tych czynników mogą wywoływać pewne zespoły teratologiczne, dobrze znane lekarzom na całym świecie. Zespoły te mogą objawiać się jako embriopatie lub fetopatie, w zależności od konkretnego czynnika i etapu ciąży, na który on wpływa.
Realizacja efektu teratogennego zależy od wielu składników, z których część jest zdeterminowana biologią zarodka. Oto najważniejsze składniki określające stopień szkodliwego działania teratogenu:
charakter teratogenu;
dawka teratogenna;
czas trwania ekspozycji;
wiek zarodka lub płodu;
predyspozycje genetyczne rozwijającego się organizmu;
cechy genetyczne organizmu matki, a mianowicie: funkcjonowanie systemu detoksykacji ksenobiotyków, neutralizacji wolnych rodników itp.
W rozwoju ludzkie ciało Najbardziej narażone są 1. i 2. krytyczny okres ontogenezy – jest to koniec 1. początku 2. tygodnia po zapłodnieniu i 3-6 tydzień ciąży. Oddziaływanie zagrożeń właśnie w drugim okresie prowadzi do powstania największa liczba VPR.
Oprócz krytycznych należy wziąć pod uwagę okresy zakończenia działania teratogenu – czyli maksymalny okres ciąży, w którym niekorzystny czynnik może wywołać zaburzenia rozwojowe. Okres ten zależy od czasu zakończenia tworzenia się narządów i różni się dla różnych narządów i tkanek, na przykład duża wada rozwojowa mózgu - bezmózgowie, może powstawać pod wpływem wpływów teratogennych do 8 tygodnia ciąży, podczas gdy ubytki przegrody międzykomorowej serca - do 10 tygodnia.
Znaczenie komponentu genetycznego rozwijającego się organizmu można wykazać na przykładzie zespołu talidomidu i fetopatii alkoholowej. Zespół talidomidu rozwinął się jedynie u 20% dzieci, których matki przyjmowały takie same dawki talidomidu podczas ciąży, na tym samym etapie.
Wpływ czynników teratogennych najczęściej realizuje się w postaci rozwoju licznych wad i anomalii rozwojowych, których powstanie zależy od dawki czynnika uszkadzającego, czasu jego narażenia oraz etapu ciąży, w którym występuje niekorzystne działanie. wystąpił.
Okresy krytyczne to okresy, w których występują ogólne i specyficzne cechy w naturze reakcji zarodka i płodu na wpływy patogenne. Charakteryzują się przewagą procesów aktywnego różnicowania komórek i tkanek oraz znacznym wzrostem procesów metabolicznych.
Pierwszy okres krytyczny od 0 do 8 dni. Liczy się od momentu zapłodnienia komórki jajowej do wniknięcia blastocysty do doczesnej. W tym okresie nie ma połączenia między zarodkiem a ciałem matki. Czynniki uszkadzające albo nie powodują śmierci płodu, albo zarodek obumiera (zasada „wszystko albo nic”). Cecha charakterystyczna okres to brak wad rozwojowych nawet pod wpływem czynników środowiskowych, które mają wyraźny efekt teratogenny. Odżywianie zarodka jest autotropowe - ze względu na substancje zawarte w jaju, a następnie z powodu płynnego wydzielania trofoblastu w jamie blastocysty.
Drugi okres krytyczny od 8 dni do 8 tygodni. W tym okresie dochodzi do powstawania narządów i układów, w wyniku czego powstają liczne wady rozwojowe. Najbardziej wrażliwą fazą jest pierwsze 6 tygodni: możliwe są wady centralnego układu nerwowego, słuchu i wzroku. Pod wpływem czynników uszkadzających rozwój początkowo zwalnia i zatrzymuje się, następnie dochodzi do przypadkowego rozrostu niektórych i zwyrodnienia innych zaczątków narządów i tkanek. W przypadku szkody liczy się nie tyle wiek ciążowy, ile czas trwania narażenia na niekorzystny czynnik.
Trzeci okres krytyczny - 3-8 tygodni rozwoju. Wraz z organogenezą następuje powstawanie łożyska i kosmówki. Pod wpływem czynnika uszkadzającego rozwój bardzo wrażliwej na uszkodzenia alantois zostaje zakłócony: następuje śmierć naczyń krwionośnych, w wyniku czego unaczynienie kosmówki ustaje wraz z wystąpieniem pierwotnej niewydolności łożyska.
Czwarty okres krytyczny - 12-14. Odnosi się do rozwoju płodu. Niebezpieczeństwo wiąże się z powstawaniem zewnętrznych narządów płciowych u płodów żeńskich z powstawaniem fałszywej męskiej hermafrodytyzmu.
Piąty okres krytyczny - 18-22 tygodnie. W tym okresie kończy się tworzenie układu nerwowego, odnotowuje się aktywność bioelektryczną mózgu, zmiany w hematopoezie i produkcję niektórych hormonów.
Krwawienie w okresie poporodowym i wczesnym okresie poporodowym. Powody. Opieka położnicza w nagłych przypadkach
Krwawienie w okresie poporodowym i poporodowym.
Wynik upośledzonego oddzielenia i uwolnienia łożyska: upośledzone wydalenie łożyska; zaburzenia kurczliwości macicy; zmiana koagulacji. Hemostaza poporodowa to złożony system składający się z 2 elementów:
Mechaniczną hemostazę zapewnia silne cofanie się mięśniówki macicy w wyniku skręcenia i ucisku spiralnych naczyń macicy. Jego skuteczność zależy od kurczliwości macicy, która nie może istnieć w nieskończoność
Hemostaza krzepnięcia - w warunkach ucisku naczyń przepływ krwi w nich zwalnia, tworzą się agregaty komórkowe, uwalniana jest tromboplastyna we krwi, aktywowany jest układ krzepnięcia krwi i pojawia się zakrzepica w obszarze łożyska. Kiedy tworzy się stabilny skrzep krwi, napięcie macicy nie odgrywa decydującej roli, ale stabilizacja skrzepu zajmuje od 2 do 3 godzin. Jeśli w tym czasie macica się rozluźni, skrzepy krwi luźno wiążą się ze ścianami naczyń, można je wypłukać i krwawienie zostaje wznowione.
W ten sposób mechaniczna hemostaza krzepnięcia wspomaga się wzajemnie i zapewnia zatrzymanie krwawienia. Normalne skurcze macicy są możliwe po całkowitym usunięciu wszystkich elementów zapłodnionego jaja. Prawidłowy okres poporodowy zapewnia odpowiednią hemostazę poporodową.
Drugie powikłanie okresu poporodowego:
a) szczelne przyczepienie łożyska
b) łożysko przyrośnięte prawdziwe
a) ta patologia jest związana ze zmianami morfologicznymi w warstwie gąbczastej podstawnej części doczesnej, czyli endometrium, powstałej w czasie ciąży. Zawiera warstwę podstawną (przylegającą do łożyska) + część torebkową (przykrywa zapłodnione jajo) + część ciemieniową (obejmuje część jamy macicy niezajętą przez zapłodnione jajo). Doczesne ma 2 warstwy: gąbczastą - tworzy sekty na łożysku, blaszka podstawna jest matczyną częścią łożyska. W obszarze płytki podstawnej otwierają się naczynia macicy i tworzą się luki, w których unoszą się kosmki kosmówkowe (wymiana między matką a płodem). W łożysku znajdują się 2 grupy kosmków: niektóre zapewniają metabolizm i są zanurzone we krwi matki, inne wrastają głęboko w blaszkę podstawną (zapewniają utrwalenie blaszki - „kosmki kotwiczne”).
Kiedy podstawna warstwa doczesnej staje się cieńsza, ponad jedna czwarta kosmków wrasta w blaszkę podstawną, nie docierając do mięśniówki macicy; tworzy się gęsty przyczep łożyska. Zmiany morfologiczne w blaszce podstawnej są wynikiem dużej liczby ciąż, interwencji wewnątrzmacicznych i zmian zapalnych w mięśniówce macicy.
Załącznik.
Kompletny - w okresie poporodowym łożysko nie oddziela się samodzielnie w ciągu 30 minut.
Częściowe - część łożyska jest oddzielona, część naczyń w okolicy łożyska zostaje otwarta, co prowadzi do krwawienia. Pozostała, nieoddzielona część łożyska zapobiega hemostazie mechanicznej. Oznaki oddzielenia łożyska są negatywne.
Profilaktyka krwotoku poporodowego (PPH) – w II okresie porodu podaje się silny lek pobudzający. Teraz nie czekają nawet 30 minut.
We wszystkich przypadkach, niezależnie od krwawienia, wykonywana jest operacja ręcznego oddzielenia i uwolnienia łożyska.
b) obserwuje się to z poważnymi zmianami w morfologii warstwy gąbczastej podstawy doczesnej. Kiedy kosmki kosmówkowe całkowicie wrosną w płytkę podstawną i zetkną się z mięśniówką macicy, łożysko staje się „akretowe”. Jeśli kosmki kosmówkowe urosną do grubości mięśnia, łożysko jest „hormonem”. Kosmki mogą rosnąć na całej grubości mięśniówki macicy aż do otrzewnej – łożyska „per creta”.
Podobnie, zależy od pełnego lub częściowego przyrostu. Ostateczną diagnozę i diagnostykę różnicową pomiędzy gęstym przyczepem a prawdziwym narostem przeprowadza się podczas ręcznego oddzielania łożyska. Jeśli przy ciasnym przyczepieniu łożysko zostanie oddzielone z trudem, ale całkowicie, to podczas akrecji odpadnie na kawałki; przy wzmożonych próbach oddzielenia łożyska dłoń zapada się w myometrium, aż do perforacji macicy. Konsekwencją łożyska przyrośniętego jest zwiększone krwawienie podczas operacji, ponieważ myometrium jest uszkodzone.
Wczesne krwawienie okres poporodowy. Przyczyny, diagnostyka, leczenie i profilaktyka.
Krwawienie z dróg rodnych występujące w ciągu pierwszych 4 godzin po urodzeniu nazywane jest krwawieniem we wczesnym okresie poporodowym.
Zatrzymanie części miejsca dziecka w jamie macicy.
Atonia i niedociśnienie macicy.
Uszkodzenie tkanek miękkich kanał rodny.
Zaburzenie układu krzepnięcia (koagulopatia).
Niedociśnienie macicy to stan, w którym napięcie i kurczliwość macicy ulegają znacznemu zmniejszeniu. Pod wpływem środków i środków stymulujących aktywność skurczową macicy mięsień macicy kurczy się, chociaż często siła reakcji skurczowej nie odpowiada sile uderzenia.
Atonia macicy to stan, w którym leki stymulujące macicę nie mają na nią żadnego wpływu. Aparat nerwowo-mięśniowy macicy jest w stanie paraliżu. Atonia macicy występuje rzadko, ale powoduje masywne krwawienie.
Obraz kliniczny krwawienia hipotonicznego wyraża się poprzez główny objaw – masywne krwawienie z macicy poporodowej, a co za tym idzie pojawienie się innych objawów związanych z zaburzeniami hemodynamicznymi i ostrą niedokrwistością. Powstaje obraz wstrząsu krwotocznego.
Stan kobiety po porodzie zależy od intensywności i czasu trwania krwawienia oraz ogólnego stanu kobiety. Fizjologiczna utrata krwi podczas porodu nie powinna przekraczać 0,5% masy ciała kobiety (ale nie więcej niż 450 ml). Jeśli siła ciała kobiety po porodzie zostanie wyczerpana, reaktywność organizmu zostanie zmniejszona, wówczas nawet niewielki nadmiar fizjologicznej normy utraty krwi może spowodować poważny obraz kliniczny u osób, które mają już małą objętość krwi (niedokrwistość, gestoza, choroby układu krążenia, otyłość).
Nasilenie obrazu klinicznego zależy od intensywności krwawienia. Tak więc, przy dużej utracie krwi (1000 ml lub więcej), w ciągu długoterminowy objawy ostrej niedokrwistości są mniej nasilone, a kobieta radzi sobie z tym schorzeniem lepiej niż z nagłą utratą tej samej lub nawet mniejszej ilości krwi, gdy szybciej może nastąpić zapaść i śmierć.
DIAGNOSTYKA
Rozpoznanie niedociśnienia ustala się na podstawie objawów krwawienia z macicy i obiektywnych danych na temat stanu macicy: w badaniu palpacyjnym macica jest duża, rozluźniona, czasem słabo wyprofilowana w kierunku przednim ściana brzucha, podczas masażu zewnętrznego może nieco się skurczyć, a następnie ponownie rozluźnić i krwawienie wznowi się.
Diagnostykę różnicową krwawienia hipotonicznego przeprowadza się w przypadku urazowych uszkodzeń kanału rodnego. W przeciwieństwie do krwawienia hipotonicznego z urazem kanału rodnego, macica jest gęsta i dobrze obkurczona. Badanie szyjki macicy i pochwy za pomocą lusterek oraz ręczne badanie ścian jamy macicy potwierdzają rozpoznanie pęknięcia tkanek miękkich kanału rodnego i krwawienia z nich.
Opróżnianie pęcherza za pomocą cewnika.
Zewnętrzny masaż macicy
Ręczne badanie jamy macicy i masaż macicy na pięści.
Równolegle z masażem macicy na pięść podaje się środki obkurczające macicę (oksytocynę, prostaglandyny). Aby utrwalić efekt zatrzymania krwawienia, możesz zastosować szew zgodnie z V.A. Łositskiej (zakłada się gruby szew katgutowy na tylną wargę szyjki macicy przez wszystkie warstwy), wprowadza się tampon zwilżony eterem (zimnym środkiem drażniącym) do tylnego sklepienia pochwy, wprowadza lód do odbytnicy i okład z lodu na podbrzusze.
Brak efektu ręcznego badania jamy macicy i masażu macicy na pięści, utrzymujące się krwawienie pozwala na rozpoznanie krwawienia atonicznego i rozpoczęcie interwencji chirurgicznej.
Po otwarciu jamy brzusznej podwiązki katgutowe zakłada się na naczynia maciczne i jajnikowe po obu stronach i odczekuje chwilę. W 50% przypadków macica kurczy się (następuje niedotlenienie mięśniówki macicy i mięsień macicy odruchowo kurczy się), krwawienie ustaje, a macica zostaje zachowana. Jednak w połowie przypadków tak się nie dzieje, zwłaszcza jeśli występują oznaki koagulopatii, wówczas krwawienia nie można zatrzymać. W takiej sytuacji jedyną metodą ratowania życia kobiety po porodzie jest amputacja lub histerektomia. Zakres operacji zależy od stanu hemostazy; jeśli występują oznaki koagulopatii, wykonuje się histerektomię.
Śmiertelność matek. Struktura. Zapobieganie.
Według WHO śmiertelność matek jest związana z ciążą, niezależnie od jej czasu trwania i umiejscowienia, śmierć kobiety, która następuje w czasie ciąży lub w ciągu 42 dni po jej zakończeniu, z jakiejkolwiek przyczyny związanej z ciążą, zaostrzonej przez nią lub jej prowadzeniem, ale nie z powodu wypadek lub przypadkowa przyczyna.
Jest to najważniejszy wskaźnik jakości i poziomu organizacji pracy placówek położniczych, skuteczności wdrażania osiągnięć naukowych w praktyce opieki zdrowotnej. Wskaźnik ten pozwala oszacować wszystkie straty kobiet w ciąży (z tytułu aborcji, ciąża pozamaciczna, patologia położnicza i pozagenitalna przez cały okres ciąży), kobiety w czasie porodu i kobiety po porodzie (w ciągu 42 dni po zakończeniu ciąży).
Wszystkie przypadki stwardnienia rozsianego dzielą się na dwie grupy:
a) Śmierć bezpośrednio związana z przyczynami położniczymi: śmierć spowodowana powikłaniami położniczymi ciąży, porodu, okresu poporodowego, a także na skutek nieprawidłowej taktyki leczenia.
b) Śmierć pośrednio związana z przyczynami położniczymi: śmierć spowodowana chorobą istniejącą wcześniej lub chorobą rozwiniętą w czasie ciąży, niezwiązaną z bezpośrednią przyczyną położniczą, ale której przebieg kliniczny został wzmocniony fizjologicznymi skutkami ciąży.
Śmiertelność matek:
liczba zgonów kobiet w ciąży i połogu w ciągu 42 lat od urodzenia dziecka/liczba urodzeń żywych*100000
Struktura śmiertelności matek:
liczba kobiet, które zmarły z danej przyczyny/ogólna liczba żon, które zmarły ze wszystkich przyczyn*100
Struktura przyczyn stwardnienia rozsianego: większość (ok. 80%) to przyczyny położnicze (najczęściej: ciąża pozamaciczna, krwawienia, poronienia pozaszpitalne), 20% to przyczyny pośrednio związane z ciążą i porodem (choroby pozagenitalne).
Obszary profilaktyki stwardnienia rozsianego: poprawa jakości opieki opieka medyczna kobiety w ciąży, kobiety w trakcie porodu i kobiety po porodzie; modernizacja szpitali położniczych i kliniki przedporodowe cały niezbędny sprzęt; profilaktyka prenatalna i powikłania poporodowe itp.
Niewydolność maciczno-łożyskowa. Diagnoza, leczenie. Zapobieganie
Niewydolność łożyska jest zespołem klinicznym spowodowanym zmianami morfofunkcjonalnymi w łożysku oraz naruszeniem mechanizmów kompensacyjnych i adaptacyjnych zapewniających użyteczność funkcjonalną płodu.
Klasyfikacja. Wyróżnia się pierwotną i wtórną niewydolność łożyska.
Pierwotna niewydolność łożyska rozwija się podczas tworzenia łożyska i najczęściej występuje u kobiet w ciąży z nawracającymi poronieniami lub niepłodnością w wywiadzie.
Wtórna niewydolność łożyska pojawia się po utworzeniu łożyska i jest spowodowana wpływami egzogennymi, chorobami, które wystąpiły w czasie ciąży.
Przebieg zarówno pierwotnej, jak i wtórnej niewydolności łożyska może być ostry lub przewlekły. Ostra niewydolność łożyska występuje w wyniku rozległych zawałów i przedwczesnego odklejenia się normalnie zlokalizowanego łożyska.
W rozwoju przewlekłej niewydolności łożyska pierwszorzędne znaczenie ma stopniowe pogarszanie się perfuzji doczesnej w wyniku zmniejszenia reakcji kompensacyjnych i adaptacyjnych łożyska w odpowiedzi na stany patologiczne organizmu matki.
Z klinicznego punktu widzenia zwyczajowo rozróżnia się względną i bezwzględną niewydolność łożyska. Niewydolność względna charakteryzuje się utrzymującą się nadczynnością łożyska i jest kompensowana. Ten typ niewydolności łożyska rozwija się z groźbą poronienia, umiarkowanymi objawami późnej gestozy (obrzęk, nefropatia I stopnia) i z reguły dobrze reaguje na leczenie.
Bezwzględna (niewyrównana) niewydolność łożyska charakteryzuje się załamaniem mechanizmów kompensacyjnych i adaptacyjnych i rozwija się wraz z nadciśnieniowymi postaciami gestozy, ostatecznie prowadząc do opóźnienia rozwoju i śmierci płodu.
Obraz kliniczny i diagnoza. Rozpoznanie niewydolności łożyska ustala się na podstawie wywiadu, przebiegu ciąży oraz badań klinicznych i laboratoryjnych. Aby ocenić przebieg ciąży, czynność łożyska i stan płodu, wykonuje się:
regularna ogólna obserwacja położnicza;
dynamiczne badanie USG w I, II, III trymestrze;
Dopplerometria;
badanie hemostazy;
oznaczenie estradiolu, progesteronu, przewlekłej gonadotropiny, a-fetoproteiny we krwi;
badanie kolpocytologiczne;
KTG płodu;
określenie wysokości dna macicy.
Obraz kliniczny poronienia zagrażającego u kobiet z niewydolnością łożyska charakteryzuje się napięciem macicy przy braku zmiany strukturalne od strony szyi. Przebiegowi prawdziwej ciąży u kobiet, u których pojawia się pierwotna niewydolność łożyska spowodowana zagrożeniem poronieniem, często towarzyszą krwawienia, autoimmunologiczne zaburzenia hormonalne i dysbioza.
Leczenie i profilaktyka. O powodzeniu działań zapobiegawczych i leczeniu niewydolności łożyska decyduje terminowe rozpoznanie i leczenie chorób współistniejących i powikłań ciąży. Jeżeli istnieje ryzyko przedwczesnego przerwania ciąży ze względu na niski poziom estrogenów, objawy odwarstwienia kosmówki lub plamienie, zaleca się leczenie małymi dawkami estrogenów.
1. Jeżeli podstawowe stężenie ludzkiej gonadotropiny kosmówkowej jest niskie, podaje się odpowiednie leki (pregnyl, profazę) przez okres do 12 tygodni. ciąża. W celu utrzymania funkcji ciałka żółtego stosuje się progesteron, duphaston i utrotestan (do 16-20 tygodni).
2. Do środków terapeutycznych i zapobiegawczych zalicza się dietę, witaminy, leczenie fizjoterapeutyczne i środki normalizujące sen.
3. Wskazane jest stosowanie przeciwutleniaczy (octan α-tokoferolu), hepatoprotektorów, nootropów, adaptogenów.
4. Głównymi lekami stosowanymi w celu utrzymania ciąży po 20 tygodniu są beta-blokery, siarczan magnezu, metacyna.
5. Po otrzymaniu danych o infekcji (zaostrzenie odmiedniczkowego zapalenia nerek, wielowodzie, wykrycie infekcji układu moczowo-płciowego) przeprowadza się etiotropową terapię przeciwbakteryjną i dezynfekcję pochwy. Powszechnie stosowane są eubiotyki, których działanie polega na konkurencyjnym wypieraniu flory patogennej i oportunistycznej.
6. B kompleksowa terapia późna gestoza koniecznie obejmuje leki poprawiające maciczno-łożyskowy przepływ krwi (mieszanina glukozy i nowokainy, reopolyglucyna, trental), wykonywane są sesje dekompresji brzucha, hiperbaryczne natlenienie.
7. W przypadku zespołu antyfosfolipidowego stosuje się leki przeciwpłytkowe (aspiryna, kuranty), heparyny drobnocząsteczkowe (fraxiparyna) i immunoglobuliny. Wysokie miano antyfosfolipidów można obniżyć za pomocą plazmaferezy
Metody badania kobiet w ciąży i kobiet w czasie porodu.
1. Historia
2. Kontrola.
3. Badanie ginekologiczne
3.1. Zewnętrzne badanie ginekologiczne – przy badaniu zewnętrznych narządów płciowych uwzględnia się stopień i charakter linii włosów
3.2. Badanie za pomocą wziernika ginekologicznego przeprowadza się po zbadaniu zewnętrznych narządów płciowych.
3.3. Badanie pochwy
3.4. Badanie dwuręczne (pochwowo-brzuszne, dwuręczne) jest główną metodą rozpoznawania chorób macicy, przydatków, otrzewnej i tkanek miednicy.
3.5. Badanie ściany odbytnicy (odbytnicy) i odbytniczo-brzusznej
3.6. Badanie odbytniczo-pochwowe – stosowane w obecności procesów patologicznych w ścianie pochwy, odbytnicy i otaczających tkankach.
4. Instrumentalne metody badań (sondowanie macicy, oddzielne łyżeczkowanie diagnostyczne, biopsja, łyżeczkowanie aspiracyjne, nakłucie jamy brzusznej, przedmuch jajowodów, cewnikowanie pęcherza).
4.1. Biopsja szyjki macicy: celowana, w kształcie stożka
a) diatermoexcision (diatermo- lub elektrokonizacja) szyjki macicy - wycięcie szyjki macicy w kształcie stożka za pomocą elektrody Rogovenki.
b) biopsja celowana
4.2. Nakłucie brzucha przez tylny sklepienie pochwy
4.3. Oddzielne łyżeczkowanie diagnostyczne - instrumentalne usunięcie błony śluzowej kanału szyjki macicy, a następnie błony śluzowej trzonu macicy.
5. Metody rentgenowskie
5. 1. Metrosalpingografia (MSG, histerosalpingografia) - rentgenowska metoda badania jamy macicy i jajowodów za pomocą środków kontrastowych
5.2. Genikografia dwukontrastowa (pneumopelwiografia, pneumogenografia, pelwiografia rentgenowska) jest badaniem rentgenowskim polegającym na wprowadzeniu do jama brzuszna gaz (podtlenek azotu, dwutlenek węgla, tlen) w połączeniu z histerosalpingografią.
6. Badania hormonalne
6.1. Funkcjonalne testy diagnostyczne służą do określenia aktywności jajników i scharakteryzowania nasycenia estrogenami organizmu:
a) badania śluz szyjkowy- metoda opiera się na fakcie, że podczas normalnego cyklu miesiączkowego właściwości fizykochemiczne śluzu ulegają zmianom
b) badanie kolpocytologiczne składu komórkowego wymazu z pochwy – na podstawie cyklicznych zmian w nabłonku pochwy.
c) pomiar temperatura podstawowa- badanie opiera się na hipertermicznym działaniu progesteronu.
d) badanie histologiczne zeskrobania endometrium. Metoda polega na pojawieniu się charakterystycznych zmian w endometrium pod wpływem hormonów steroidowych jajników.
d) badanie krwi. Polega ona na tym, że skład powstających pierwiastków zmienia się zgodnie z fazami cyklu menstruacyjnego.
e) skórny test alergiczny. Na podstawie pojawienia się reakcji alergicznej w odpowiedzi na podanie leków hormonalnych
6.2. Hormonalne testy czynnościowe służą do diagnostyki miejscowej i różnicowej chorób endokrynologicznych
a) test z progesteronem - stosowany w przypadku braku miesiączki o dowolnej etiologii w celu wykluczenia postaci macicy;
b) badanie z estrogenami i progesteronem – przeprowadza się w celu wykluczenia (potwierdzenia) macicznej lub jajnikowej postaci braku miesiączki.
c) test deksametazonowy – służy do określenia charakteru hiperandrogenizmu u kobiet z objawami wirylizacji, na podstawie hamowania wydzielania ACTH.
d) próba z klomifenem – wskazana w przypadku choroby, której towarzyszy brak owulacji, często na tle skąpo- lub braku miesiączki.
e) próba z luliberyną – przeprowadzana, gdy próba z klomifenem jest ujemna.
7. Metody endoskopowe
7.1. Kolposkopia: prosta i rozszerzona. Mikrokolposkopia.
Kolposkopia (waginoskopia, wulwoskopia) to metoda diagnostyczna służąca do określenia stanów patologicznych części pochwowej szyjki macicy, kanału szyjki macicy, pochwy i zewnętrznych narządów płciowych poprzez badanie ich za pomocą specjalnych przyrządów optycznych (kolposkopów).
Mikrokolposkopia jest przyżyciowym badaniem histologicznym pochwowej części szyjki macicy.
7.2. Histeroskopia - badanie z wykorzystaniem układów optycznych
7.3. Laparoskopia to badanie narządów jamy brzusznej i miednicy za pomocą instrumentów optycznych przez przednią ścianę jamy brzusznej.
Kuldoskopia to podobna procedura, ale badanie przeprowadza się przez tylny sklepienie pochwy.
8. Diagnostyka USG
Opcje USG w ginekologii:
1) kontakt
2) przezpochwowe
Metody oceny stanu płodu wewnątrzmacicznego.
Profil biofizyczny płodu to zespół badań obejmujący aktywność motoryczną, ruchy oddechowe, tętno, napięcie płodu oraz ilość płynu owodniowego, który pozwala zobiektywizować stan płodu.
Metoda badania: a) przeprowadza się test bezstresowy (patrz pytanie: test bezstresowy)
b) płód obserwuje się za pomocą ultradźwięków w czasie rzeczywistym przez 30 minut w celu ustalenia kryteriów (ruchy oddechowe płodu, aktywność motoryczna płodu, napięcie płodu, objętość płynu owodniowego). Badanie najlepiej przeprowadzić po jedzeniu.
Interpretacja testu: a) test normalny – liczba punktów 10-8 (na 10 możliwych)
b) podejrzane – 6-7 punktów, tj. możliwa jest przewlekła asfiksja i badanie należy powtórzyć w ciągu 24 godzin
c) mniej niż 6 punktów – poważne niebezpieczeństwo przewlekłego niedotlenienia, które wymaga powtarzania test bezstresowy natychmiast i jeśli wynik jest taki sam, konieczna jest dostawa awaryjna
d) każda liczba punktów mniejsza niż 10 przy obecności małowodzia jest wskazaniem do natychmiastowego porodu (o ile małowodzie nie wiąże się z pęknięciem błon płodowych).
Zalety testu:
a) można wykonać w trybie ambulatoryjnym
b) niski odsetek wyników fałszywie dodatnich (w porównaniu do testu bezstresowego)
c) brak przeciwwskazań
d) można stosować na początku trzeciego trymestru ciąży
Wady testu:
a) wymaga umiejętności specjalisty USG
b) wymaga więcej czasu (45-90 min).
Ciąża mnoga, cechy przebiegu i postępowanie przy porodzie.
Ciąża mnoga: obraz kliniczny oraz diagnostyka, prowadzenie ciąży i porodu.
Ciąża mnoga to ciąża, w której w macicy rozwijają się jednocześnie dwa lub więcej płodów. Dzieci urodzone w trakcie ciąża mnoga, nazywane są bliźniakami. Wśród urodzonych bliźniąt przeważają chłopcy.
Czynniki przyczyniające się do rozwoju ciąży mnogiej:
a) dziedziczność - częściej w rodzinach, w których matka, ojciec lub oboje rodzice są bliźniakami.
b) wiek i liczba urodzeń – prawdopodobieństwo wzrasta wraz ze wzrostem wieku i liczby urodzeń.
c) stymulacja owulacji.
d) recepcja doustne środki antykoncepcyjne przez długi czas (ponad 6 miesięcy) i poczęcie w ciągu miesiąca po ich zaprzestaniu
Diagnostyka.
1. Objawy kliniczne: szybki wzrost macicy i rozbieżność między jej wielkością (przekroczeniem) a wiekiem ciążowym; mały rozmiar prezentowanej głowy ze znaczną objętością ciężarnej macicy i wysokim położeniem jej dna; wczesne uczucie ruchów płodu (od 15-16 tygodnia ciąży); identyfikacja w macicy po badaniu palpacyjnym trzech lub więcej dużych części płodu; określenie poprzez osłuchiwanie dwóch lub więcej autonomicznych stref bicia serca płodu; dotykanie małych części płodu w różnych częściach macicy; określenie macicy siodłowej, rowka podłużnego lub poziomego między płodami; identyfikacja czynników predysponujących do ciąży mnogiej.
2. Fono- i elektrokardiografia płodu, radiografia, USG (od 6 tygodnia - 100%) - pozwalają zidentyfikować wiarygodne oznaki ciąży.
Przebieg porodu.
Najczęściej przebieg porodu jest normalny. Po rozwarciu szyjki macicy rodzi się pierwszy płód, a następnie wydalany jest kolejny. Po urodzeniu dzieci łożysko każdego płodu oddziela się od ściany macicy i rodzi się łożysko.
Powikłania: przedwczesny poród; przedwczesne i wczesny wylew płyn owodniowy; anomalie pracy; przedwczesne oddzielenie łożyska drugiego płodu; krwawienie hipotoniczne w okresie poporodowym i wczesnym okresie poporodowym; niedotlenienie owoców.
Zarządzanie porodem.
Dostawa. O wyborze metody porodu decyduje się przed porodem lub na jego początku.
1. Cesarskie cięcie. Produkowany po 36 tygodniu ciąży, gdy żywotność płodu jest większa.
Wskazania: cierpienia wewnątrzmaciczne jednego z płodów z nieopracowanym kanałem rodnym u kobiety rodzącej; prezentacja płodów pośladkowych i skomplikowany wywiad położniczy; pozycja poprzeczna pierwszego płodu; przedwczesne oddzielenie łożyska jednokosmówkowego; obecność zdiagnozowanego worek owodniowy(ciąża jednoowodniowa), która może prowadzić do splątania i wypadnięcia pępowiny w przypadku jej pęknięcia membrany; brak efektu wywołania lub stymulacji porodu przez trzy godziny. Kwestia cięcia cesarskiego do 36 tygodnia jest ustalana indywidualnie, biorąc pod uwagę wskazania i dostępność warunków opieki nad wcześniakiem.
2. Poród naturalnym kanałem rodnym. Na przedwczesna ciąża przeprowadzane bez zabezpieczenia krocza. Aby zapobiec uszkodzeniu przesuwającej się głowy pierwszego płodu, wykonuje się znieczulenie okołoszyjkowe i sromowe 0,25% roztworem nowokainy, a także preparację krocza. Na wszelki wypadek prezentacja zamka Pierwszy owoc otrzymuje pomoc ręczną, bardzo ostrożnie, jeśli to możliwe. Osłabienie porodu w drugiej fazie porodu koryguje się poprzez frakcyjne podanie oksytocyny.
Kiedy ciąża trwa dłużej niż 36 tygodni lub jest donoszona, często pojawia się osłabienie aktywności pchania. Aby temu zapobiec w okresie wydalania, konieczne jest dożylne podawanie oksytocyny w małej dawce. Jednocześnie podejmowane są środki zapobiegające niedotlenieniu płodu. Jeżeli powikłania wynikają ze strony matki lub płodu, okres wydalenia pierwszego płodu należy przyspieszyć metodami chirurgicznymi (ekstrakcja próżniowa, kleszcze położnicze, ekstrakcja płodu końcem miednicy). Po urodzeniu pierwszego płodu, płodowy i matczyny koniec pępowiny należy starannie zawiązać – w przypadku bliźniąt jednojajowych drugi płód może umrzeć z powodu utraty krwi przez pępowinę pierwszego płodu, jeśli nie zostanie ona zawiązana. Po urodzeniu pierwszego płodu przeprowadza się badanie zewnętrzne w celu ustalenia położenia drugiego płodu i charakteru jego bicia serca. Jeśli rodząca jest w dobrym stanie, a drugi płód znajduje się w pozycji podłużnej, 10-15 minut po urodzeniu pierwszego dziecka następuje otwarcie worka owodniowego, powolne wypuszczenie wód pod kontrolą dłoni i umożliwienie porodu. postępować naturalnie. Jeżeli skurcze macicy są niewystarczające, stosuje się stymulację porodu za pomocą oksytocyny lub prostaglandyn. W przypadku wykrycia niedotlenienia wewnątrzmacicznego drugiego płodu lub krwawienia z powodu odklejenia się łożyska, należy natychmiast otworzyć worek owodniowy i rozpocząć poród operacyjny, biorąc pod uwagę stopień przygotowania kanału rodnego i możliwość szybkiego porodu. Kiedy drugi płód znajduje się w pozycji poprzecznej, wykonuje się zewnętrzną rotację położniczą i otwiera się worek owodniowy, co prowadzi do samodzielnego porodu drugiego płodu. W wyjątkowych przypadkach wykonuje się łączny obrót płodu na nogę, a następnie jego ekstrakcję za koniec miednicy.
Czasami w takiej sytuacji uciekają się do cięcia cesarskiego. W przypadku ciąży z trzema lub więcej płodami, poród do cesarskie cięcie. Cięcie cesarskie wykonuje się także w przypadku łączenia bliźniąt.
Trzeci etap porodu wymaga szczególnej uwagi, dokładnego monitorowania stanu rodzącej i ilości utraconej przez nią krwi. Kontynuuje się dożylne podawanie oksytocyny. W przypadku wystąpienia krwawienia natychmiast podejmuje się działania mające na celu usunięcie łożyska z jamy macicy. Urodzone łożysko jest dokładnie badane, aby upewnić się, że jest nienaruszone i aby ustalić, czy bliźnięta są jednojajowe czy braterskie.
W pierwszych godzinach po porodzie uważnie monitoruje się stan kobiety po porodzie, skurcze macicy i ilość krwi uwalnianej z dróg rodnych. Jeśli to konieczne, zwiększ skurcz macicy za pomocą środków macicznych i innych środków.
Krytyczne okresy embriogenezy
Okresy krytyczne obserwuje się na etapach ontogenezy, charakteryzujących się największą szybkością rozwoju organizmu, kiedy staje się on bardziej wrażliwy na szkodliwe skutki. Zewnętrzne i czynniki wewnętrzne, na które w tych okresach wrażliwość jest szczególnie duża, mogą przyspieszyć, spowolnić lub zatrzymać rozwój organizmu.
W 1960 roku embriolog P.G. Svetlov zaproponował hipotezę okresów krytycznych. Wyróżnił trzy grupy wpływów środowiskowych:
1 – skutki szkodliwe prowadzące do śmierci lub patologii;
2 – wpływy modyfikujące powodujące odchylenia o charakterze niepatologicznym (morfozy lub mutacje);
3 – naturalny wpływ środowiska, zapewniający normalny rozwój ciało.
Efekty te wpływają na późniejszą stabilność organizmu i jego prawidłowy rozwój. Krytyczne okresy ontogenezy są związane z realizacją programu genetycznego jednostki różne okresy ontogeneza poprzez aktywację pracy określonych genów. W granicach indywidualnej normy reakcji zapewniona jest możliwość aklimatyzacji organizmu i jego przystosowania do warunków środowiskowych.
Wszystkie okresy krytyczne można podzielić na kilka typów.
1. Okresy krytyczne dla całego organizmu, w których szkodliwe skutki mogą doprowadzić do śmierci zarodka. Najczęstsza śmierć zarodka następuje początkowe etapy embriogeneza.
2. Poszczególne okresy krytyczne są różne dla każdego narządu i tkanki.
3. Okresy krytyczne dla komórki.
W krytycznych okresach embriogenezy zarodek lub płód staje się wysoce reaktywny i labilny w stosunku do działania czynników. W tym przypadku powstają anomalie rozwojowe, ponieważ walka organizmu z procesami destrukcyjnymi (funkcja regulacyjna narządów i układów płodu) może zostać osłabiona w tych okresach. Bezpośrednią przyczyną anomalii może być zatrzymanie rozwoju tego lub innego układu ciała w krytycznym okresie lub naruszenie koordynacji szybkości reakcji kompensacyjnych układów rozwijający się płód. Im wcześniej zarodek znajduje się na etapie rozwoju, tym bardziej różni się jego reakcja na działanie czynnika chorobotwórczego od reakcji układów dorosłego organizmu.
W ontogenezie człowieka okresy krytyczne obejmują:
1) nawożenie;
2) implantacja (7-8 dni embriogenezy);
3) rozwój osiowego kompleksu zawiązków narządów i łożyska (3-8 tygodni);
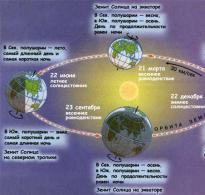
4) rozwój mózgu (15-20 tygodni);
5) tworzenie głównych układów ciała, w tym układu rozrodczego (20-24 tygodnie);
6) narodziny.
1.4.9. Wpływ czynników środowiskowych na przebieg embriogenezy człowieka
Każde uderzenie zakłócające prawidłowy przebieg embriogenezy może powodować wady rozwojowe zarodków. Około połowa wszystkich płodów nie dożywa porodu. Większość ma włączone nieprawidłowości wczesne etapy rozwój. Takie zarodki nie mogą wszczepić się w ścianę macicy. Inne zarodki implantują się, ale nie mogą zostać osadzone w ścianie macicy na tyle, aby zapewnić pomyślną ciążę. Prawie 90% zarodków uległo wcześniej aborcji jeden miesiąc, są anomalne. Rozwój wielu ludzkich embrionów zostaje zakłócony we wczesnych stadiach. Około 5% wszystkich urodzonych dzieci ma oczywiste deformacje. Niektóre z nich nie zagrażają życiu, inne stanowią poważne odchylenia od normy.
Śmierć zarodków w różnych okresach ontogenezy jest nierówna u zarodków męskich i żeńskich. Kobieta: im bliżej początku ciąży, tym więcej martwych płodów to płci męskiej. Wynika to z faktu, że w trakcie embriogenezy powstaje więcej zarodków męskich niż żeńskich. Zatem stosunek liczby zarodków męskich i żeńskich w 1. miesiącu ciąży wynosi 600:100, a w 5. miesiącu – 140:100. Jeśli przyjmiemy, że na 1000 ciąż umiera średnio 300 płodów, wówczas wartość śmiertelności wewnątrzmacicznej przedstawiają następujące wskaźniki: w pierwszym miesiącu umiera 112 zarodków, w drugim - 72, w trzecim - 43, a następnie wskaźniki przejdź do singla. Zatem pierwsze dwa miesiące ciąży stanowią około 2/3 wszystkich przypadków śmierci zarodków.
Najczęstszymi czynnikami zakłócającymi prawidłowy przebieg embriogenezy są: przejrzała dojrzałość komórki jajowej, zaburzenia metaboliczne u matki, niedotlenienie, substancje toksyczne we krwi matki (np. leki, substancje odurzające, nikotyna, alkohol itp.), infekcja (zwłaszcza wirusowa) itp.
Czynniki powodując anomalie, nazywane są teratogennymi. Teratogeny działają w pewnych krytycznych okresach. Dla każdego narządu okresem krytycznym jest czas jego wzrostu i powstawania określonych struktur. Różne narządy mają różne okresy krytyczne. Na przykład serce człowieka kształtuje się pomiędzy 3 a 4 tygodniem. Ludzki mózg i szkielet są stale wrażliwe na szkodliwe wpływy, od 3 tygodnia po poczęciu aż do końca ciąży.
Istnieje wiele znanych teratogenów powodujących mutacje genowe i chromosomalne. Teratogeny wywierają bezpośredni wpływ na DNA lub pośredni wpływ poprzez systemy replikacji, naprawy i rekombinacji. Mutageny środowisko W zależności od ich charakteru, dzieli się je najczęściej na fizyczne, chemiczne i biologiczne.
DO mutageny fizyczne obejmują wszystkie rodzaje promieniowania jonizującego, pierwiastki radioaktywne, promieniowanie ultrafioletowe, zbyt wysokie lub niska temperatura itp. Efekty fizyczne powodują uszkodzenie wszystkich komórek, ale najbardziej wrażliwe na napromieniowanie są komórki znajdujące się w procesie intensywnego podziału. Komórki aktywnie rozwijającego się organizmu lub nowotworu są bardziej podatne na promieniowanie niż inne. Na przykład standardowa fluorografia wykonywana na populacji w celu wykrycia gruźlicy nie powoduje żadnych znaczących szkód u osoby dorosłej. Jednak takie napromieniowanie (lub prześwietlenie zęba, prześwietlenie kończyny w przypadku urazu itp.), wykonane w pierwszych dniach po zapłodnieniu, aż do zagnieżdżenia zarodka w ścianie macicy, doprowadzi do do jego śmierci. Nie będzie żadnych deformacji, zarodek umrze, a kobieta może nawet nie zauważyć przerwanej ciąży.
Mutageny chemiczne– silne środki utleniające i redukujące (azotany, azotyny itp.), produkty naftowe, rozpuszczalniki organiczne, leki (np. leki immunosupresyjne, dezynfekcyjne itp.). Na przykład stosowanie chininy może powodować głuchotę u płodu. Bardzo słaby środek uspokajający, talidomid, powszechnie stosowany w latach 60. XX wieku, może powodować deformacje, w których kości długie brakuje kończyn lub są one poważnie zdeformowane, w wyniku czego u dziecka rozwijają się kończyny przypominające focze płetwy. Niektóre mutageny chemiczne obejmują dodatki do żywności i inne związki chemiczne.
Znaczący szkodliwy wpływ na rozwijający się zarodek alkohol i palenie mają wpływ. Pijąc alkohol w ilościach większych niż 50-85 g dziennie, dzieci odczuwają opóźnienie fizyczne i rozwój umysłowy. Kobiety, które są nałogowymi palaczami (wypalają 20 i więcej papierosów dziennie) często rodzą dzieci z mniejszą masą ciała w porównaniu z dziećmi kobiet niepalących. Palenie znacząco zmniejsza liczbę i ruchliwość plemników w jądrach u mężczyzn palących co najmniej 4 papierosy dziennie.
Działanie teratogenne ma także wiele sztucznie wytworzonych substancji wykorzystywanych w gospodarce narodowej, zwłaszcza pestycydy i substancje organiczne zawierające rtęć.
DO mutageny biologiczne obejmują niektóre wirusy (odry, zapalenia wątroby, grypy, różyczki), produkty przemiany materii i antygeny niektórych drobnoustrojów. Na przykład u kobiet, które w pierwszej trzeciej ciąży chorowały na różyczkę, co 6 przypadków rodzą się dzieci z zaćmą, wadami serca i głuchotą. Im wcześniej wirus różyczki zaatakuje kobietę w ciąży, tym większe ryzyko, że będzie miał wpływ na płód. Pierwotniaki z klasy sporozoanów Toxoplasma gondii mają działanie teratogenne. Jeśli matka jest chora na toksoplazmozę, toksoplazma może przedostać się przez łożysko do płodu i spowodować uszkodzenie mózgu i oczu.
Wielki wpływ na rozwój zarodka wpływa stan zdrowia matki.
Procesy patologiczne, występujący w organizmie matki w ciągu pierwszych 7 dni po zapłodnieniu, może prowadzić do ciąży pozamacicznej (ektopowej). Ten ostatni przypadek wynosi 0,8–2,4 przypadków na 100 ciąż donoszonych (około 6% hospitalizowanych patologii ginekologicznych). W 98-99% przypadków zarodek jest przyczepiony jajowód. Ciąża jajnikowa, szyjna i brzuszna występuje rzadko. Śmiertelność o godz ciąża pozamaciczna stanowi około 7% wszystkich zgonów kobiet w ciąży. Historia ciąży pozamacicznej jest wspólna przyczyna niepłodność wtórna. Działanie różnych czynników patologicznych na wczesną embriogenezę człowieka może powodować przyleganie łożyska i kret groniasty. Przy ciągłym wpływie niekorzystnych czynników w powstawanie patologii zaangażowanych jest wiele narządów płodu, przede wszystkim centralny układ nerwowy, serce itp. Dopiero od 63. dnia ciąży ryzyko wystąpienia anomalii embriogenezy zaczyna się zmniejszać. Wszystkie przedstawione powyżej fakty nakładają na przyszłych rodziców ogromne obowiązki w zakresie zapobiegania skutkom na organizm kobiety w ciąży. czynniki szkodliweśrodowisko i stres emocjonalny zwłaszcza w okresie, gdy zarodek znajduje się we wczesnej fazie rozwoju, a kobieta nie wie o swojej ciąży.
Niedotlenienie można uznać za jedną z przyczyn wad wrodzonych. Hamuje powstawanie łożyska, rozwój zarodka, a w niektórych przypadkach prowadzi do rozwoju wad wrodzonych i śmierci płodu. Niedożywienie matki, niedobór mikroelementów prowadzą do rozwoju wad centralnego układu nerwowego, wodogłowia, skrzywienia kręgosłupa, wad serca itp.
Często prowadzą do chorób endokrynologicznych u kobiety w ciąży spontaniczne poronienia lub zaburzenia różnicowania narządów płodu, które decydują o dużej śmiertelności wczesnodziecięcej. Działanie teratogenne udowodniony na cukrzycę.
Znana jest zależność stanu zdrowia dzieci od wieku ich rodziców. Na przykład wrodzone wady układu mięśniowo-szkieletowego i układy oddechowe Nieco częściej obserwuje się je u dzieci młodych matek niż u dzieci matek w wieku 22-35 lat. Matki powyżej 35. roku życia rodzą więcej dzieci z wieloma wadami, w tym z wadami ośrodkowego układu nerwowego. Ustalono, że pojawienie się rozszczepu warg, podniebienia i achondroplazji u płodu zależy od wieku ojca.
Stosunkowo częste odstępstwa od normy obejmują narodziny bliźniaków. Istnieją bliźnięta jednojajowe i dwujajowe. Jeżeli całkowite rozwidlenie zarodka nastąpi na etapie dwóch blastomerów lub na etapie gastruli, wówczas z tej samej zygoty rodzą się normalne bliźnięta jednojajowe, posiadające ten sam genotyp, płeć i podobny przyjaciel na przyjacielu. Rzadziej obserwuje się podział zarodka nie na dwie, ale na większą liczbę części (poliembrion). Braterskie bliźniaki powstają w wyniku jednoczesnego dojrzewania dwóch lub więcej jaja i prawie jednoczesne zapłodnienie. Czasami rodzą się bliźnięta syjamskie. Nazywa się je syjamskimi od nazwy kraju w Azji Południowo-Wschodniej, gdzie w 1811 roku urodzili się dwaj syjamscy bracia. Złączone bliźnięta są zawsze identyczne. Ich powstanie może nastąpić w wyniku niepełnego podziału zarodka i połączenia dwóch lub więcej zarodków identyczne bliźniaki we wczesnych stadiach rozwoju. Czasami jedno z bliźniaków jest tylko dodatkiem do drugiego.
Anomalie rozwojowe u ludzi obejmują: atawizmy- przejaw oznak odległych przodków zwierząt (nadmierny wzrost włosów, zachowanie ogona, dodatkowe gruczoły sutkowe itp.).
Zwyczajowo rozróżnia się 4 główne typy wad wrodzonych:
1. Wada rozwojowa to wada morfologiczna narządu, części narządu lub dużej powierzchni ciała, powstająca w wyniku wewnętrznego zaburzenia procesu rozwojowego (czynniki genetyczne).
2. Zaburzenie – wada morfologiczna narządu, części narządu lub dużej powierzchni ciała, powstała na skutek działania przeszkody zewnętrznej lub jakiegokolwiek wpływu na początkowo prawidłowy proces rozwoju (czynniki teratogenne i zaburzenia implantacji).
3. Deformacja - naruszenie kształtu, wyglądu lub położenia części ciała spowodowane wpływami mechanicznymi.
4. Dysplazja - zaburzenie organizacji komórek w tkance i jego następstwo morfologiczne (proces i następstwo dyshistogenezy).
DO wady wrodzone rozwoju obejmują także następujące zaburzenia morfogenezy zarodkowej:
Agenezja to całkowity wrodzony brak narządu.
Aplazja to wrodzony brak narządu z zachowaniem szypułki naczyniowej.
Hipoplazja to niedorozwój narządu, polegający na niedoborze jego masy lub wielkości o więcej niż 2 segmenty, różniącym się od średniej dla w tym wieku wskaźniki. W tym przypadku prostej hipoplazji, w przeciwieństwie do dysplazji, nie towarzyszy naruszenie struktury narządu.
Przerost (przerost) to wrodzony wzrost masy i rozmiaru narządu w wyniku wzrostu liczby (przerost) lub objętości (przerost) komórek.
Makrosomia (gigantyzm) - wzrost długości ciała (lub poszczególnych narządów).
Heterotopia to obecność komórek lub tkanek jednego narządu w tych obszarach lub nawet w innym narządzie, gdzie nie powinno ich być (wyspy chrząstki ze ściany oskrzeli w płucach).
Heteroplazja to zaburzenie różnicowania komórek w tkance. Na przykład wykrycie komórek nabłonka płaskiego przełyku w uchyłku Meckela.
Ektopia to lokalizacja narządu w nietypowym dla niego miejscu (na przykład lokalizacja serca poza klatką piersiową).
Podwojenie lub zwiększenie liczby narządu lub jego części: polidaktylia - zwiększenie liczby palców, polisplenia - obecność kilku śledziony itp.
Atrezja to brak naturalnego kanału lub otworu (atrezja przełyku, wodociąg Sylwiusza, odbyt).
Stenoza to zwężenie kanału lub otworu.
Nierozdzielenie (połączenie) - narządów lub bliźniąt jednojajowych. Nazwy wad tej grupy zaczynają się od przedrostka „syn” lub „sym”: syndaktylia, symfalagizm.
Trwałość to zachowanie struktur embrionalnych w narządzie.
Dyschronia to naruszenie tempa rozwoju narządu lub jego struktur.